Ответы школьного этапа «Сириус» по Химии 15.10.2024
Задания 7-8 класс
1. Одно из популярных латинских изречений гласит: «Ignorantia non est argumentum» (Отрицание не есть доказательство). Сколько символов химических элементов‑металлов спрятано в этой фразе? Игнорируйте пробелы и регистр.
Запишите химический символ самого лёгкого из этих элементов.
Запишите химический символ самого тяжёлого из этих элементов.
2. В кулинарном рецепте рекомендуется использовать для заготовки грибов следующий состав маринада (в масс. %):
Соль 7.2%
Сахар 1.6%
Уксус 0.9%
Плотность всех жидкостей примите равной 1 кг/л. Соответствие объёма и массы приведено в таблице.
Ингредиент Столовая ложка Чайная ложка
Сахар 20 г 6г Соль 22г 7г Уксус 15 г 5 г
Сколько и каких ингредиентов потребуется взять для приготовления маринада, если хозяйка отмерила 1 столовую ложку уксусной эссенции (70 %‑ный раствор), а больше уксуса у неё дома нет? Ответ выразите в столовых и чайных ложках, округлите до ближайших целых.
Сахар: ст.л и ч.л. Соль: ст.л и ч.л.
Какой объём маринада при этом получится? Ответ выразите в литрах, округлите до десятых.Число л
3. Установите соответствие между изображениями и назначением химической посуды.
Получение газообразных веществ
Хранение и взвешивание небольших количеств веществ
Прокаливание навесок вещества
Отмеривание приблизительного объёма жидкости
Точное отмеривание определённого объёма жидкости (аликвоты)
Выпаривание растворов при нагревании
4.Выберите только химические явления:
Свёртывание крови
Образование радуги после дождя
Разряд молнии
Скисание молока
Пожелтение листвы осенью
Вспенивание соды при гашении уксусом
5. Вам выдана смесь, состоящая из деревянных опилок, стальной стружки, мраморной крошки и поваренной соли. В какой последовательности необходимо выполнить действия, чтобы разделить компоненты этой смеси? В качестве первого действия используйте добавление воды.
Добавление воды
lock
Действие магнитом
Фильтрование
Удаление твёрдого вещества с поверхности раствора
Выпаривание воды
6. Заполните пропуски во фразеологизмах формулами соответствующих химических веществ.
Глаз .
Толочь в ступе.
Куй , пока горячо.
Не всё то ,что блестит.
Слово , а молчание .
Прошёл огонь, воду и трубы.
7. К каким классам химических соединений относятся вещества, используемые в быту? В случае растворов укажите, к какому классу веществ относится компонент, определяющий свойства этого раствора.
Вода
Питьевая сода
Столовый уксус
Алмаз
Иод
Марганцовка
Кислота
Основание
Соль
Простое вещество
Оксид
8. Выберите только жидкости, являющиеся растворами:70 %‑ный этанол
Минеральная вода
Дистиллированная вода
Уксусная эссенция
Иодная настойка
Нашатырный спирт
9. Запишите химические символы элементов, названных в честь учёных, важнейшие заслуги которых указаны ниже.
Создатель теории относительности .
Учредитель престижной премии .
Один из создателей квантовой механики, автор модели атома
10. Сумма коэффициентов в реакции алюминия с бромом равна 7. Сколько атомов алюминия вступит во взаимодействие с 30 атомами брома?
11. Дан список веществ: гидроксид кальция, углекислый газ, оксид бария, азотная кислота, питьевая сода, медь, хлорид железа (III).
Запишите формулы тех из них, с которыми может провзаимодействовать гидроксид натрия. Каждый ответ записывайте в отдельное поле, добавляя их при необходимости.
12. На рисунке представлено изображение молекулы кофеина.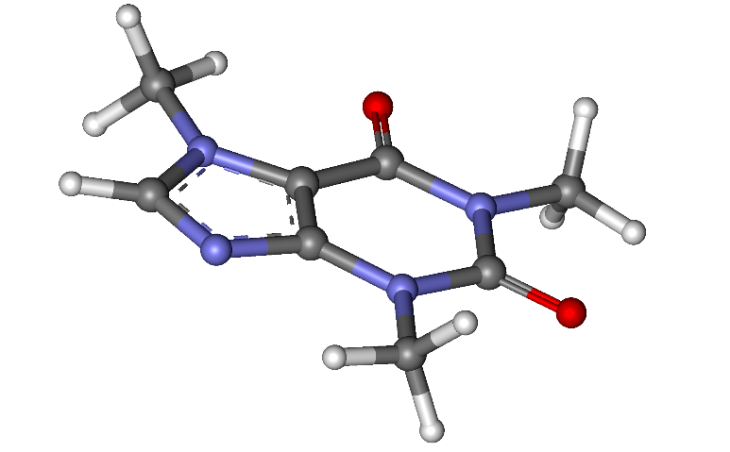
Белыми шариками обозначены атомы водорода, чёрными углерода, синими азота, красными кислорода.
Какое количество вещества электронов содержится в 10 г кофеина? Ответ выразите в молях, округлите до десятых.
Задания 9 класс
1. Какую массу железоаммонийных квасцов (NH4Fe(SO4)2⋅12H2O) следует растворить в 100г горячей воды, чтобы получить раствор с мольной долей атомов водорода 65.0 %? Ответ выразите в граммах, округлите до десятых.
2. Навеску гидроксида натрия массой 6.4 г растворили в 150мл серной кислоты с концентрацией 0.5моль/л (т.е., содержащей 0.5моль кислоты в литре раствора). Объём полученного раствора довели до 200мл и отобрали из него пробу (аликвоту) объёмом 20.0мл. Добавленный к раствору фенолфталеин окрасился в малиновый цвет. Какой минимальный объём серной кислоты с концентрацией 0.05 моль/л следует добавить к отобранной пробе, чтобы фенолфталеин стал бесцветным? Ответ выразите в миллилитрах, округлите до десятых.
3. В ребусе зашифрована формула химического соединения, которое применяется в промышленном получении некоторого металла. Рисунки соответствуют элементам, а числа показывают их процентное содержание по массе. Элемент, представленный на третьей картинке, входит в состав зубных паст.
Запишите химические символы зашифрованных элементов в порядке возрастания атомных масс. Каждый ответ записывайте в отдельное поле.
Запишите химическую формулу зашифрованного вещества.
4. Школьника попросили привести примеры пяти оксидов неметаллов. Он предложил следующий набор:
OF2 CO Cl2O7 H2O SiO2
Найдите ошибку.Из представленного набора веществ выберите все те, которые НЕ участвуют в синтезе серной кислоты.FeS2 SO2 V2O5 NaCl
5. Навеску токсичного соединения А, окрашивающего пламя горелки в жёлто‑зелёный цвет, массой 1.000г разложили с потерей массы 0.123г. Получившееся соединение B реагирует с серной кислотой с образованием соединения C, нетоксичность которого определяет его использование в самых разных областях, от медицины до изготовления деталей конструктора LEGO. Объём газа, выделившегося в первой реакции, составил 85 мл при н.у.
Определите состав соединения A. В ответ запишите его формулу
6. Сумма коэффициентов в реакции белого фосфора с концентрированной серной кислотой составляет 33. Сколько атомов фосфора взаимодействует с 30 молекулами серной кислоты?
Запишите формулу продукта окисления фосфора в этой реакции.
7. Молекула вещества, присутствующего практически в любой домашней аптечке, образована атомами двух элементов и содержит 18 электронов. Запишите название этого вещества.
Запишите формулу данного вещества.
Сколько моль протонов содержится в 5.1 г этого вещества?
Ответ округлите до десятых.
8. В древности людям были известны только семь металлов. Это число соотносилось с количеством планет, которые признавали астрономы тех времён. Каждой планете приписывали знак, одновременно служивший символом металла, находившегося под её влиянием. Заполните таблицу.
Ag
Fe
Sn
Au
Cu
Pb
Hg
9. В какой последовательности необходимо выполнить действия, чтобы с наименьшими затратами выделить графит из смеси сульфата натрия, стальной стружки, графита и иода?
Возгонка
Добавление воды
Добавление соляной кислоты
Фильтрование
Действие магнитом
10. Одним из методов получения металлов из оксидов является алюминотермия восстановление оксида металлическим алюминием. Условием возможности применения данного метода получения металлов является в первую очередь экзотермичность процессов. Основываясь на теплотах образования ряда оксидов, рассчитайте тепловые эффекты реакций восстановления приведённых ниже оксидов металлов алюминием и определите, в каких из этих случаев алюминотермия применима в качестве метода получения металла.
11. Установите соответствие между формулой вещества и описанием его строения.
Содержит ковалентную неполярную связь, способно образовывать водородные связи
Содержит ковалентную неполярную связь, образует ионную кристаллическую решётку
Содержит ковалентную полярную связь, образует ионную кристаллическую решётку
Na2O2
HCl
H2O2
HF
C (графит)
NH4Cl
NaCl
12. При проведении элементного анализа были определены брутто‑формулы ряда солей. Определите типы этих солей.
Cr2N2O7H8
CaC2H2O6
SN2O4H8
Cu2CH2O5
Средняя
Кислая
Двойная
Основная
Комплексная
Задания 10 класс
1. Одной из наиболее показательных реакций, демонстрирующих окислительную способность высшего оксида элемента X, является его взаимодействие с этиловым спиртом (реакция «буря в пробирке») с образованием трёх оксидов: жидкого, твёрдого (ω(O)=36.78%) и газообразного при н.у. При этом сам высший оксид можно получить в результате взаимодействия соли A с концентрированной серной кислотой. Растворы этой калиевой соли окрашены в малиново‑фиолетовый цвет и в медицине часто используются как антисептическое средство.
Запишите формулу соли A.
Запишите сумму минимальных целых коэффициентов в реакции «буря в пробирке».
2. Уравнение Менделеева‑Клапейрона (pV=nRT) формула, устанавливающая зависимость между абсолютной температурой (K), давлением (Па), объёмом (м3) и количеством (моль) идеального газа, используя коэффициент пропорциональности универсальную газовую постоянную R=8.314Дж/(моль⋅К) =0.082л⋅атм/(моль⋅К).
Как изменится давление идеального газа при изотермическом сжатии, то есть при уменьшении объёма при постоянной температуре?
Увеличится
Уменьшится
Не изменится
Два одинаковых сосуда с одинаковыми давлениями P, температурами и числом моль газа соединили. Температура в ходе процесса оказалась постоянной. Каким было установившееся давление идеального газа?
2P
P
P/2
3. При сжигании смеси, состоящей из 1 моль кислорода и 2 моль водорода, выделяется 484 кДж теплоты. Сколько теплоты выделяется при сжигании 9 г водорода в избытке кислорода? Ответ выразите в килоджоулях, округлите до целых.
4. В водном растворе серной кислоты (H2SO4) число атомов водорода равно 2.4⋅1025, а число атомов серы 4.02⋅1023. Определите массовую долю серной кислоты в этом растворе. Ответ выразите в процентах, округлите до десятых. Постоянную Авогадро примите равной 6⋅1023 моль−1.
5. К 142.00г насыщенного при 25 ∘C раствора хлорида железа (III) добавили 15.80г безводной соли, после чего в осадок выпал кристаллогидрат состава FeCl3⋅6H2O. Определите массу кристаллогидрата, выпавшего в осадок, если растворимость безводного хлорида железа (III) при 25 ∘C составляет 70.30г на 100.00г воды. Ответ выразите в граммах, округлите до десятых.
6. Взяли три навески одной и той же безводной соли X. Первую навеску растворили в воде и пропустили через раствор электрический ток. В результате реакции на аноде выделился жёлто‑зелёный газ A с молярной массой 71г/моль, а на катоде образовался красно‑розовый осадок металла. На вторую навеску подействовали концентрированной серной кислотой, при этом выделился газ B, раствор которого в воде окрашивает лакмус в красный цвет. К раствору газа B прилили раствор нитрата серебра, в результате чего образовался белый творожистый осадок вещества C. Третью навеску соли X растворили в воде и к полученному голубому раствору прилили раствора гидроксида натрия. В результате образовался осадок вещества D светло‑голубого цвета. Запишите формулы веществ A–D, X.
7. 449 грамм эквимолярной смеси хлората MClO3 и перхлората MClO4 одновалентного металла прокалили до образования хлорида MCl и полного выделения из них кислорода, объём которого составил 78.4 литра при нормальных условиях. Запишите химический символ металла, образующего указанные соли.
8. Трёхэлементное органическое вещество A, молярная масса которого не превышает 80г/моль, сожгли в избытке кислорода, при этом образовались углекислый газ, вода и хлороводород. Продукты сгорания разделили на 3 равные части. Первую часть полученной смеси пропустили через твёрдый KOH, при этом весь газ поглотился полностью, а масса щёлочи увеличилась на 222.5г. Вторую часть газовой смеси пропустили через P4O10, при этом из газовой смеси поглотилось только одно вещество, а масса самой газовой смеси уменьшилась на 54г. Наконец, третью часть газовой смеси пропустили через избыток раствора нитрата серебра, что привело к выпадению 143.5 г белого осадка.
Запишите брутто‑формулу A.
9. Органические вещества A и B являются изомерами, но при комнатной температуре находятся в разных агрегатных состояниях. Вещество A относительно малорастворимо в воде, в то время как B смешивается с водой в любых соотношениях. Растворимость одного из этих веществ в другом неограничена. A можно получить при нагревании более лёгкого гомолога B с концентрированной серной кислотой. Отношение масс кислорода и водорода в этих веществах составляет 8:3. Определите формулы веществ A и B.
10. В современном мире одним из основных источников энергии является горючее топливо. В таблице приведены основные виды горючего топлива, используемого для отопления помещений, теплоты их сгорания и стоимость.

Для отопления 1 м2 помещения в течение 1 часа зимой необходимо 980 кДж тепла.
Какое топливо выгоднее использовать во время отопительного сезона?
Метан
Уголь
Одинаково
Определите стоимость более дешёвого топлива, потраченного за день на обогрев 1 м2 помещения. Если в предыдущем вопросе вы ответили «одинаково», запишите значение для любого из типов. Ответ выразите в рублях, округлите до целых.
11. В настоящее время чрезвычайно интенсивно развивается ядерная медицина, использующая для лечения различных заболеваний, в том числе онкологических, радиоактивные изотопы элементов. Наиболее перспективным радионуклидом для борьбы со злокачественными опухолями щитовидной железы является изотоп иода 123I.
Зависимость концентрации радиоактивных изотопов от времени подчиняется закону:
C=C0⋅2−t/T где C0 начальная концентрация изотопа, T период полураспада изотопа, t время, прошедшее с начала измерения концентрации. Через какое время количество изотопа уменьшится в 1024 раза? Период полураспада 123I 13 часов. Ответ выразите в часах, округлите до целых.
12. В написанных ниже реакциях зашифрованы вещества A, B и C.
2A −→t∘ 2B +4C+O2+4C+O2
B+2HNO3→A+H2OB+2HNO3→A+H2O
4C+O2+2H2O→4HNO3
Массовая доля кислорода в нитрате двухвалентного металла A равна 50.79%.Определите молярные массы веществ A C. Ответ выразите в г/моль, округлите до целых
Задания 11 класс
1. В основе демонстрационного опыта «фонтан», который так любят проводить на различных студенческих практикумах, лежит способность газа X растворяться в воде. Для получения этого газа к поваренной соли добавляют концентрированную серную кислоту и выделяющийся газ X собирают в колбу. В горлышко колбы вставляют пробку с газоотводной резиновой трубкой, которую затем опускают в сосуд с водой, обычно подкрашенной лакмусом или другим кислотно‑основным индикатором.
Запишите формулу газа X.
Выберите цвет лакмуса в чистой воде:
Выберите цвет лакмуса после растворения газа X:
Красный
Фиолетовый
Синий
2. В скорую медицинскую помощь (СМП) поступил вызов: мужчина, 32 года, внезапная потеря сознания, страдает сахарным диабетом, использует инсулин. Звонивший считает, что потеря сознания связана с недавней физической нагрузкой пострадавшего. Исходя из анамнеза, врач СМП предположил, что у пациента гипогликемическая кома. Врачу скорой помощи необходимо ввести пациенту раствор глюкозы объёмом 50 мл. Плотности всех жидкостей, кроме раствора глюкозы, считайте равными 1 г/мл.
Определите массу глюкозы (C6H12O6), необходимую для приготовления 50 мл её раствора с концентрацией 400 мг/мл плотностью 1.13 г/мл. Ответ выразите в граммах, округлите до целых.
Определите массовую долю глюкозы в этом растворе. Ответ выразите в процентах, округлите до десятых.
3. Бинарное вещество X основной компонент редчайшего минерала, который можно найти только в ничтожных количествах в некоторых метеоритах и горных породах. Вещество X химически весьма инертное, его мелкий порошок медленно растворяется [1] в силициевой водке (смесь концентрированных кислот HNO3 и HF с выделением бесцветного газа A чуть легче воздуха, моментально буреющего [2] при соприкосновении с атмосферой. Помимо газа A, продуктом этой реакции является бесцветный газ B, при пропускании которого через избыток известковой воды выпадает белый осадок [3] c массовым содержанием кальция 40.00%. Наконец, помимо газов A и B, в растворе образуется двухосновная комплексная кислота C которая не может существовать в чистом виде. При упаривании раствора эта кислота разлагается [4] с образованием двухэлементного газа D с массовым содержанием фтора 73.08%. Уравнения протекающих реакций приведены ниже.
[1] 3X+8HNO3+18HF=3C+8A+3B+10H2O
[2] 2A+O2=2 Бурый газ
[3] B+Ca(OH)2=Белый осадок+H2O
[4] C=2HF+D
Определите формулы веществ A- D. Запишите молярную массу каждого соединения.
Запишите формулу вещества X, если из его навески массой 10 г можно получить 5.6 л газа B и 5.6 л газа D. Объёмы измерены при нормальных условиях.
4. На рынке представлено большое количество различных газированных лимонадов. В их составе можно обнаружить разнообразные органические и неорганические соединения. Выберите вещества, которые можно встретить в составе среднестатистического газированного лимонада:
Бензоат натрия
Умами
Этиловый спирт
Крахмал
Лимонная кислота
Анилиновый чёрный
Аспартам
Фосфорная кислота
Углекислый газ
Азот
Карбонат кальция
Сахар
5. Один из основоположников химической кинетики, знаменитый учёный Якоб Хендрик Вант‑Гофф предложил простое эмпирическое правило, учитывающее влияние температуры на скорость химической реакции (теперь оно известно как правило Вант‑Гоффа): «При изменении температуры на 10 градусов скорость гомогенной реакции может изменяться в 2–4 раза (коэффициент γ) в зависимости от природы реагирующих веществ и выбранного интервала температур». Это правило выражает уравнение:
W(T2)=W(T1)⋅γ(T2− T1)/10 где W(T1) и W(T2) скорости реакции при температурах T1 и T2. На бутылке с молоком указан срок годности 2 недели при температуре 4 ∘C. Скорость скисания обратно пропорциональна сроку годности W∼1/t, где t срок годности.
За сколько дней испортится молоко при стоянии на солнце при температуре 34.0 ∘C? Считайте, что скорость прокисания молока увеличивается в 2.5 раза при увеличении температуры на 10 градусов Цельсия. Ответ выразите в сутках, округлите до десятых.
6. Подавляющее большинство химических реакций являются обратимыми, то есть протекающими в двух противоположных направлениях. Например, кажущаяся необратимой реакция образования хлорида серебра при взаимодействии водных растворов хлорида натрия и нитрата серебра на самом деле тоже является обратимой. При добавлении крепкого раствора щёлочи к хлориду серебра последний превращается в тёмно‑коричневый осадок X.
Запишите формулу вещества X.
Выберите реагенты, которые приводят к растворению осадка X. Среди продуктов реакции не должно быть осадка.
Водный раствор аммиака
Ацетилен
Тиосульфат натрия
Разбавленная серная кислота
Сульфид натрия
Концентрированная соляная кислота
7. Ниже представлено описание реакций получения четырёх газов X1 X4, плотность которых одинакова при нормальных условиях и равняется 1.25 г/л.
X1: гидрирование ацетилена на отравленном катализаторе;
X2: проведение обменной реакции между гидридом натрия и фторидом бора;
X3: кипячение водного раствора нитрита аммония;
X4: нагревание смеси муравьиной кислоты с концентрированной серной кислотой.
Запишите формулы веществ X1 X4
Ещё один необычный газ Y может быть получен при взаимодействии бинарных газов Y1 и Y2 с плотностями по водороду 18.25 и 17 соответственно. Вещество Y является продуктом реакции соединения.
Запишите формулы веществ Y, Y1 и Y2
Какой тип кристаллической решетки имеет твёрдое вещество Y?
Металлическая
Атомная
Ионная
Молекулярная
8. Порообразователи (вспенивающие агенты) индивидуальные вещества или смеси, предназначенные для получения газонаполненных материалов посредством создания в них системы открытых (сообщающихся) и/или закрытых (изолированных) ячеек, или пор.
Вещество X несуществующая в свободном виде дикарбоновая кислота, которая представляет собой производное диимида (R−N=N−R) Для неё известны производные, например, её диэтиловый эфир Z может быть получен в две стадии по приведённой ниже схеме.
Запишите брутто‑формулы веществ X, Y, Z, если при сжигании 17.4 г вещества Z образуется 13.44 л (н.у.) углекислого газа и 9.00 мл воды.
ZXY
Диамид кислоты X нашёл применение в качестве одного из самых эффективных органических вспенивателей. Выделяемые при разложении этого вещества газы неядовиты, негорючи, а само вещество дешёвое, безопасное и имеет высокий коэффициент газообразования (газовое число, мл/г).
Запишите формулу газа чуть легче воздуха, который является основным продуктом разложения диамида кислоты X
9. Этилен самое производимое органическое соединение в мире; общее мировое производство этилена превышает 200 млн тонн в год.
Весьма полезное вещество A (ω(O)=37.2%) в промышленности получают окислительным (под действием кислорода) присоединением этилена к уксусной кислоте в присутствии солей Pd2+. Запишите формулу вещества A.
В некоторых условиях при взаимодействии этилена с веществом A в качестве единственного продукта реакции образуется твёрдое вещество B, состоящее из полимерных молекул. При сжигании навески 1.00 г вещества B в избытке кислорода образуется 1.50 л (н.у.) углекислого газа.
Сколько молекул этилена приходится на одну молекулу вещества А в реакции синтеза полимера B? Ответ округлите до целых.
10. Простейший алифатический кетон ацетон впервые получен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки вещества X. Однако точно определить химический состав ацетона удалось только в 1832 году Юстусу фон Либиху и Жану‑Батисту Дюма. Ниже представлена схема получения ацетона из веществ X, Y и Z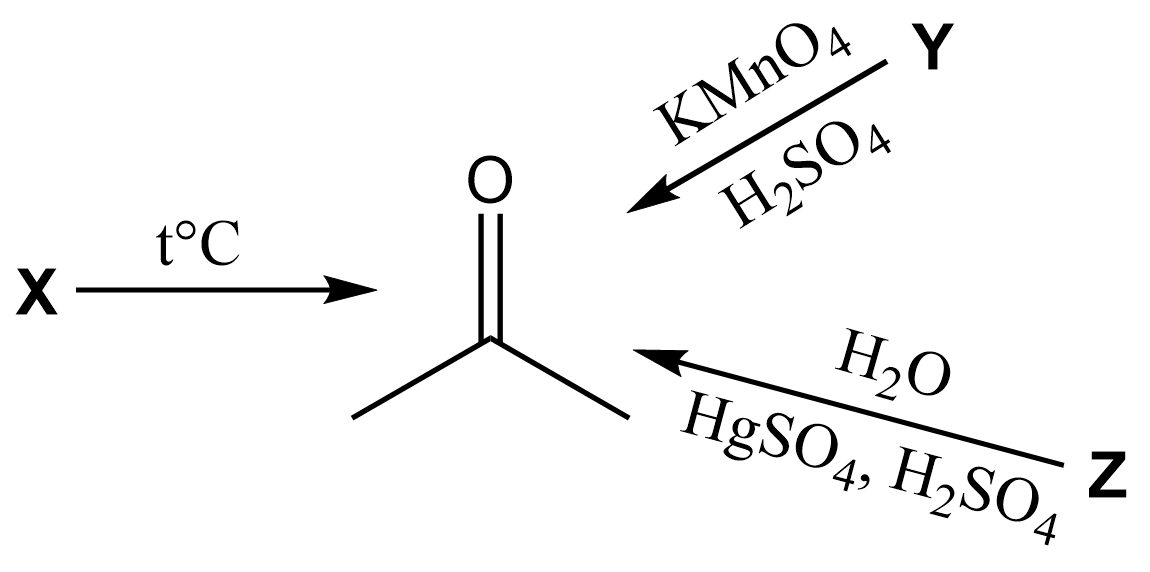
Вещество X является солью монокарбоновой кислоты с массовым содержанием свинца в 63.69%. Плотность паров Y по Z равна 2.1, причём Z является ближайшим гомологом ацетилена. При окислении Y сернокислым раствором перманганата калия ацетон образуется в качестве единственного углеродсодержащего продукта. Определите формулы веществ X, Y, Z. Ответ выразите в г/моль, округлите до целых.
11. Установите соответствие между реагентами, условиями, субстратами и продуктами, которые образуются при соответствующих химических превращениях.Субстрат Реагенты, условия Продукты Бензолсульфокислота Cl2, 150 ∘C
HBr, 0 ∘C
Br2,P(красн., изб.)
NaOHр-ор
Нагревание
Cl2,FeCl3Бензолсульфонат натрия Бутадиен‑1,3 Cl2, 150 ∘C
HBr, 0 ∘C
Br2,P(красн., изб.)
NaOHр-ор
Нагревание
Cl2,FeCl33‑бромбутен‑1 Толуол Cl2, 150 ∘C
HBr, 0 ∘C
Br2,P(красн., изб.)
NaOHр-ор
Нагревание
Cl2,FeCl3Пара‑хлортолуол Ацетат аммония Cl2, 150 ∘C
HBr, 0 ∘C
Br2,P(красн., изб.)
NaOHр-ор
Нагревание
Cl2,FeCl3Амид уксусной кислоты Изобутилен Cl2, 150 ∘C
HBr, 0 ∘C
Br2,P(красн., изб.)
NaOHр-ор
Нагревание
Cl2,FeCl32‑метил‑3‑хлорпропен Уксусная кислота Cl2, 150 ∘C
HBr, 0 ∘C
Br2,P(красн., изб.)
NaOHр-ор
Нагревание
Cl2,FeCl3Бромангидрид бромуксусной кислоты
12. На рисунках изображены структурные формулы органических соединений. Выберите те, которые НЕ могут соответствовать реально существующему стабильному индивидуальному органическому веществу:
Официальные задания и ответы Сириус для 7-8, 9, 10, 11 класса школьного этапа 2024/25 всероссийской олимпиады школьников ВсОШ по Химии 4-ой группы 15.10.2024 на официальном сайте Сириуса uts.sirius.online.




 Задания для 7 класса
Задания для 7 класса