Школьный этап Сириус по Математике для 2-ой группы 17 октября 2025 г.
Вопросы и ответы 11 класс
Задание 1. Ароматический углеводород A взаимодействует со смесью концентрированных азотной и серной кислот с образованием вещества B. Взаимодействие Bс цинком в бромоводородной кислоте даёт раствор соединения C с массовой долей брома 46.0 % . Добавление щёлочи к C приводит к образованию D , не содержащего элементы тяжелее 15 а. е. м. Продуктом реакции D с бромом является белый осадок E , содержащий в 3 раза больше атомов брома, чем в C . Расставьте индексы в молекулярных формулах веществ.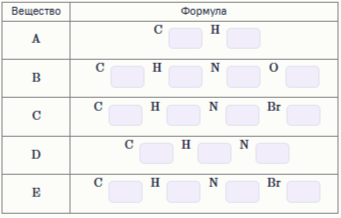
Задание 2. Транс‑алкен AA массой 2.8 г реагирует с 8 г брома, также A способен окисляться водным раствором перманганата калия в слабощелочной среде при охлаждении с образованием B, который даёт сине‑васильковое окрашивание с Cu(OH)2 в присутствии щёлочи. Если проводить жёсткое окисление A перманганатом калия в кислой среде, то образуется единственный органический продукт C. Взаимодействие B с C в соотношении 1:2 при подкислении концентрированной серной кислотой приводит к образованию DD. Определите молярные массы зашифрованных веществ. Ответ выразите в г/моль, округлите до целых.Вещество A B C D Молярная масса, г/моль
Задание 3. Вещество A хлорид четырёхвалентного металла, обозначаемого однобуквенным символом и названного в честь одной из планет Солнечной системы. Вещество B оксид трёхвалентного металла, название которого в русском языке имеет женский род. A и B сплавили в вакуумированной кварцевой трубке. Оба вещества прореагировали полностью, без изменения степеней окисления элементов, с образованием двух веществ C и D. Жёлто‑зелёное трёхэлементное вещество CC с массовым содержанием хлора 21.82 % осело в горячей части трубки, а белое бинарное вещество D в холодной. После прокаливания C в инертной атмосфере образовались вещества E (коричневый порошок, содержащий 11.85 % кислорода по массе) и снова A, причём эта реакция не является окислительно‑восстановительной.
Запишите формулы веществ A–E.Вещество A B C D E Формула
Задание 4. Дана схема химических превращений хрома.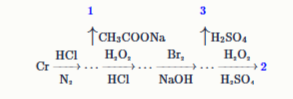
Известно, что: комплексное соединение 1 1 содержит четверную связь Cr Cr ω(Cr)=27.64 %; бинарное соединение 2 обладает синей окраской (Cr)=39.39 %); оранжевое соединение 3 содержит хром в степени окисления +6. Расставьте индексы в формулах соединений.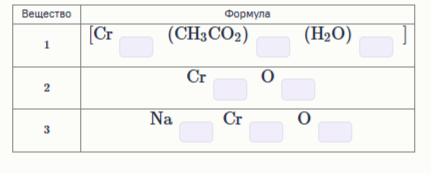
Задание 5. Если к мета‑бромтолуолу добавить магний в эфире, на следующей стадии провести реакцию с углекислым газом, а затем подкислить раствор, то образуется вещество A. Далее соединение A взаимодействует с пентахлоридом фосфора с образованием вещества B, которое, в свою очередь, может реагировать со вторичным симметричным амином C4H1N, в этом случае получается соединение C, которое используется в качестве репеллента. Расставьте индексы в молекулярных формулах веществ.Вещество Формула A C H O B C HH O Cl C C H O N
Задание 6. Бинарное соединение серы X может быть получено пропусканием избытка бинарного водородного соединения Y через раствор SCl2 в тетрахлорметане. X является термодинамически неустойчивым соединением, при его сжигании на воздухе образуется только смесь из двух газов Z1 и Z2 в соотношении 1:2. Известно, что в полученной смеси только газ Z2 вызывает помутнение известковой воды, а его молярная масса в 2.29 раза больше молярной массы Z1. В то же время молярная масса Z1 в 1.65 раза больше молярной массы Y. Под действием горячей воды 1 моль X образует бледно‑жёлтый осадок простого вещества Z3, 4 моль вещества Y и 3 моль Z2 . Запишите формулы веществ X, Y, Z1, Z2 и Z3 .Вещество X Y Z1 Z2 Z3 Формула
Задание 7. Число 7 считается счастливым, и, возможно, с этой задачей вам тоже повезёт. Определите массовую долю карбида кальция в техническом образце, если известно, что из этого образца массой 77 г при обработке водой получено 7.7 л горючего газа, объём которого измерен при температуре 77 ∘ C и давлении 777 мм рт. ст. Ответ выразите в процентах, округлите до целых. Для нахождения объёма идеального газа при условиях, отличных от нормальных ( 0 ∘ C , 1 1 атм), необходимо воспользоваться уравнением Клапейрона‑Менделеева PV=nRT. Эта формула устанавливает зависимость между абсолютной температурой ( K =∘C+273), давлением (Па) , объёмом ( м3)и количеством мольидеального газа, используя коэффициент пропорциональности универсальную газовую постоянную R=8.314 Дж(( моль ⋅ К))=0.082.
Задание 8. При смешении двух жидкостей объём раствора обычно получается меньше, чем сумма объёмов чистых компонентов. Тем не менее, этим изменением можно пренебречь для жидкостей с близкой энергией межмолекулярных взаимодействий, например, для алканов и некоторых других углеводородов. Тетралин имеет плотность 0.97 г/мл, пентан 0.63 кг/л. Юный химик приготовил смесь этих двух веществ, но забыл, в каком соотношении. Измерив плотность полученного раствора, он получил значение 0.92 г/см3 . Определите объёмную долю тетралина в смеси. Считайте, что при смешении объём раствора будет равен сумме объёмов чистых компонентов. Ответ выразите в процентах, округлите до десятых.
Задание 9. Ядерные реакции традиционно рассматривают в рамках физики, но, как говорится, химия это самая сложная физика. Установите соответствие между ядерными превращениями и их типами. На схемах не указаны протоны, нейтроны, электроны и альфа‑частицы. Примечание: В ходе протонного/нейтронного распада из ядра испускается протон/нейтрон соответственно и образуется новое ядро. Пример нейтронного распада: 5He→ 4He+n0. В ходе протонного/нейтронного/электронного захвата ядро присоединяет один протон/нейтрон/электрон соответственно и образуется новое ядро. Пример электронного захвата: 13N+e→ 13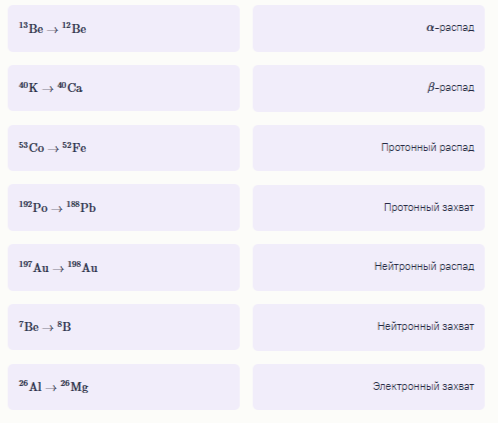
Задание 10. Для понимания химических свойств не всегда достаточно знать только молекулярную формулу. Зачастую необходимо представлять пространственное строение частицы. Установите соответствие между частицами и их характеристиками.
P4
S2−8
N−5
S8
P4O10
C60
N+5
O2F2
Несколько циклов
Один цикл
Цикла нет
Олимпиада «Сириус» ответы, вопросы по Химии 11 класс, школьный этапа Всероссийской олимпиады 2 группа от 17 октября 2025 года. Официальный вариант с вопросами по химическим элементам, простым и сложным веществам.




 Варианты заданий
Варианты заданий