Олимпиада Взлет школьный этап Химии 11 класс
1. Соединения X и Y имеют большое значение для промышленности и синтеза других органических соединений. Для их получения применяется так называемый кумольный способ, стадии которого представлены ниже: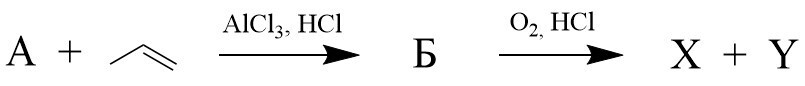
Соединение А – циклический углеводород с массовой долей углерода 92,31% Б также является углеводородом. После окисления соединения Б и последующего гидролиза были получены вещества X и Y, причем молярная масса Y выше молярной массы X.
Об X известно, что после полного сжигания 2 г этого соединения в избытке кислорода образуется 2,317 л газа (при н.у.) и 1,862 г жидкости.
Y – слабая органическая кислота. Это соединение ядовито, оставляет ожоги на коже. При долгом хранении на воздухе розовеет, что связано с его окислением.
Определите вещество А Запишите ответ в виде формулы.Формулу запишите БЕЗ пробелов, знаков препинания и дополнительных символов, используйте только ЛАТИНСКИЕ символы (например, H2S)
Запишите молярную массу Б Ответ дайте в г/моль и округлите до целых. В качестве ответа вводите целое число. Никаких иных символов, кроме используемых для записи числа (в частности, пробелов), быть не должно.
Запишите повседневное название вещества Х. В качестве ответа укажите ОДНО слово в именительном падеже БЕЗ пробелов, знаков препинания и дополнительных символов.
Запишите повседневное название вещества Y. В качестве ответа укажите ОДНО слово в именительном падеже БЕЗ пробелов, знаков препинания и дополнительных символов.
2. Многообразие органических кислот очень велико, и все они различны по своей силе. Кислотными свойствами может обладать молекула не только с общей формулой R-COOH, к которой мы так привыкли. Как правило, сила кислоты определяется степенью диссоциации: чем легче отрывается протон – тем сильнее будет кислота.
В качестве тренировочного примера сравним между собой кислотность этилового спирта и воды. Углеводородный радикал (C2H2-OH) по сравнению с атомом водорода (H-OH) является более сильным донором электронной плотности, что делает связь O-H менее полярной в случае этилового спирта и, следовательно, менее кислотной (она хуже разрывается, а значит, образуется меньше свободных протонов). Углеводородный радикал (C2H5-) как бы «добавляет» электронной плотности на атом кислорода, благодаря чему, кислород может не так сильно перетягивать ее с соседнего атома водорода, чтобы компенсировать свою бо́льшую электроотрицательность. Говоря научными терминами углеводородный радикал (C2H5-) оказывает положительный индуктивный эффект (+I). Таким образом, вода является более сильной кислотой, чем этиловый спирт.
Данный факт легко подтвердить и экспериментально: металлический натрий вступает в бурную реакцию с водой, которая часто сопровождается воспламенением кусочка металла, в то время как при погружении его в этанол он медленно растворяется с шипением.
Ниже представлен список некоторых органических молекул, проявляющих кислотные свойства:
1) CF3COOH
2) CH3COOH
3) CH3CH(OH)CH3
4) CH3CH2CH2OH
5) C2H2
6) CH2FCOOH
Отдельные органические кислоты обладают кислотными свойствами за счёт подвижности водорода, связанного с углеродом. Так, некоторая органическая кислота X является широко используемым лигандом для получения комплексов d-металлов. Соединение X зеркально-симметрично, его структура идентична своему отражению в плоскости симметрии. X не реагирует с реактивом Толленса и содержит 8% водорода по массе, а мольное соотношение углерода и кислорода составляет С:О=5:2.
1. Расставьте кислоты, начиная с самой слабой и заканчивая самой сильной.
1) CF3COOH
2) CH3COOH
3) CH3CH(OH)CH3
4) CH3CH2CH2OH
5) C2H2
6) CH2FCOOH
2. Запишите структурную формулу Х В ответе запишите молярную массу Х в г/моль с точностью до целых. Никаких иных символов, кроме используемых для записи числа (в частности, пробелов), быть не должно.
3. Металлоорганические соединения – это класс органических соединений, в которых атом металла непосредственно связан с атомом углерода органического фрагмента. Эти вещества играют большую роль в синтезе более сложных органических соединений. Их особенность заключается в том, что в связи с большой разницей электроотрицательности углерода и металла (как правило, лития или магния), на атоме углерода возникает частично отрицательный заряд.
Ниже представлен список некоторых органических веществ:
1. CH₃MgBr
2. CH₃NHLi
3. C₆H₅ONa
4. CH₃CH₂CH₂CH₂Li
5. P(C₆H₅)₃
6. Al(C₂H₅)₃
Вещество A является одним из металлоорганических соединений. Оно активно взаимодействует с водой, при этом выделяется бесцветный газ Б, образуется гелеобразный осадок В, и в растворе остается соль Г. В состав вещества А входит предельный углеводородный фрагмент и остаток, состоящий из атома металла и галогена. Массовая доля металла в соединении В составляет 41,37%, тогда как в соединении А массовая доля металла – 27,12%.
1. Из представленного списка выберите соединения, относящиеся к металлоорганическим. Укажите ВСЕ, которые Вы считаете верными, однако обратите внимание, что в случае, если не все верные ответы отмечены или отмечен неверный вариант, балл обнуляется.
1. CH₃NHLi
2. CH₃CH₂CH₂CH₂Li
2. CH₃NHLi
3. C₆H₅ONa
4. CH₃CH₂CH₂CH₂Li
5. l(C₂H₅)₃
6. Al(C₂H₅)₃ CH₃MgBr
4. Химик Колбочкин нашёл на полке в лаборатории банку с неизвестным мелкодисперсным порошком металла Х и решил определить, что это за металл. Для этого он с помощью специального прибора установил, что удельная площадь поверхности данного порошка составляет 49,9 м2/г. Далее он установил, что плотность данного порошка составляет 12,02 г/см3. Старший коллега Колбочкина, аспирант Пробиркин, зная, что это за порошок, подсказал Колбочкину, что в одной частице данного порошка содержится 35600 атомов металла Х.
Справочные данные: удельная площадь поверхности – это отношение площади поверхности частицы к массе частицы. Площадь поверхности сферы рассчитывается по формуле S=4пp2
Считая, что порошок содержит одинаковые сферические частицы, рассчитайте радиус наночастиц порошка. Ответ дайте в нанометрах и округлите до целого. Никаких иных символов, кроме используемых для записи числа (в частности, пробелов), быть не должно. Пример: 3
Определите металл Х В ответ запишите химический символ элемента. Например: Na
5. Гетерополисоединения — это кислорoдсoдержащие комплексы переходных металлов, содержащие гетероатомы в составе центрального аниона. Наиболее устойчивой и широко изученной формой таких соединений является структура Кеггина, имеющая общую формулу: [XM12O40], где X — гетероатом, а M — атом переходного металла в высокой степени окисления.
Аммонийная соль A является дигидратом. Она кристаллизуется в структуре Кеггина и является продуктом качественной реакции на фосфат анион, причём содержание фосфора в А равно 1,6205% Для проведения реакции раствор подкисляют азотной кислотой. Получают А из аммонийной соли В, в которой M, а , а атомная доля M составляет 7.
Определите металл М. В ответ запишите молярную массу металла в г/моль, округлив её до целых.
Запишите реакцию образования вещества А из B, если в качестве носителя фосфат-ионов выступает ортофосфорная кислота. В ответ запишите сумму минимальных целочисленных коэффициентов перед веществами.
Ответы и задания на всероссийскую олимпиаду школьников ВСОШ школьного этапа для 11 класса по Химии в Московской области 50 регион на 26-27 сентября 2025 г.




 Варианты ВсОШ Химия 11 класс
Варианты ВсОШ Химия 11 класс